LA FERROPORTINA
Una proteina, due diverse patologie: emocromatosi tipo 4
e deficit di ferroportina
La ferroportina 1 è una proteina che ha un ruolo fondamentale nel sistema di regolazione del metabolismo del ferro. E' codificata dal gene SLC40A1 (Solute Carrier Family 40 Member 1), situato sul braccio lungo del cromosoma 2 (2q32.2) ed espresso in numerose linee cellulari.
La ferroportina è l'unica proteina, oggi nota, che regola l'uscita del ferro dalla cellula al sangue che, grazie all'azione della ceruloplasmina, si lega alla transferrina. Il suo ruolo è quindi determinante per mantenere adeguati livelli di ferro circolante nel sangue che attraverso il legame con la transferrina può così raggiungere i diversi siti di utilizzo e rilasciare in modo regolato il ferro alle cellule grazie al legame con lo specifico recettore 1 della transferrina (TFR1).
Anche se la ferroportina è espressa quasi ovunque, il ruolo fondamentale della proteina è quello svolto a livello delle cellule dell'epitelio intestinale, dove regola il rilascio del ferro dietetico dalla cellula duodenale al sangue, e a livello delle cellule macrofagiche della milza, dove regola il meccanismo di riciclo del ferro che deriva dalla distruzione dei globuli rossi invecchiati.
Quest'ultima via è quella che ricicla la quasi totalità del ferro che viene mobilizzato giornalmente (circa 20-25 mg, rispetto agli 1-2 mg assorbiti a livello intestinale) e che permette di soddisfare le esigenze dei diversi tessuti ed in particolare del midollo eritroide (quello che produce i globuli rossi), che è il principale utilizzatore del ferro dal punto di vista quantitativo.
La ferroportina è a sua volta regolata per garantire questo adeguato flusso di ferro evitando nello stesso tempo che si possa accumulare in quantità eccessive rispetto alle necessità. La proteina che regola l'azione della ferroportina è l'epcidina, un piccolo peptide sintetizzato dal fegato in funzione del fabbisogno di ferro: in caso di maggior fabbisogno di ferro la sintesi di epcidina viene ridotta e viceversa; questo, perché epcidina ha un'azione inibitoria sulla funzione di ferroportina.
In pratica, epcidina si lega alla ferroportina presente sulla membrana cellulare e ne blocca la funzione oppure la internalizza e ne favorisce la degradazione. Questa azione fa sì che il numero di molecole di ferroportina funzionanti, presenti sulla membrana delle cellule (dei macrofagi e dell'epitelio intestinale), si riduca e quindi con esso, si riduca anche la capacità di esporto di ferro nel sangue. L'opposto accade se la quantità di epcidina circolante si riduce perché in questo caso un numero maggiore di molecole di ferroportina saranno presenti sulla membrana delle cellule pronte a rilasciare il ferro nel sangue (per dettagli ulteriori vedere Il metabolismo del ferro).
Come già descritto nell'articolo
L'emocromatosi, mutazioni a carico del gene SLC40A1 possono dare
origine a due forme diverse di patologia da sovraccarico di ferro: l'emocromatosi
tipo 4 (SLC40A1-HC) dovuta a mutazioni cosiddette
gain-of-function e il deficit di ferroportina
dovuto a mutazioni cosiddette loss-of-function.
Entrambe
hanno una trasmissione di tipo dominante. Questo vuol dire che basta un
singolo difetto (e un unico genitore) per trasferire la malattia ai
figli con una probabilità del 50%. Tuttavia, le due patologie sono molto
diverse tra di loro al punto che ormai il deficit di ferroportina non è
più annoverato tra le forme di emocromatosi, ma costituisce un'entità
distinta fra le patologie da sovraccarico di ferro.
Emocromatosi tipo 4
Dell'emocromatosi tipo 4 si è già parlato nell'articolo
L'emocromatosi. In breve, le mutazioni
responsabili determinano una resistenza all'azione di epcidina che non è
più in grado di esercitare il suo effetto inibitorio attraverso il
blocco e la degradazione della ferroportina stessa. Il risultato è
un'aumentata presenza di molecole di ferroportina sulla membrana (da cui
il concetto di gain-of-function, aumento di funzione) e un aumentato
rilascio di ferro nel sangue da parte delle cellule duodenali e dei
macrofagi, un aumento della saturazione della transferrina e un
progressivo accumulo di ferro nel fegato e nei diversi tessuti.
In
pratica, si realizza un quadro del tutto simile alle altre forme di
emocromatosi che si manifesta in età adulta con caratteristiche simili
alla forma di emocromatosi più comune (emocromatosi tipo 1 o HFE-HC).
Nella figura 1 è schematizzato il meccanismo che caratterizza questa
forma di emocromatosi e che conduce allo sviluppo del sovraccarico di
ferro.
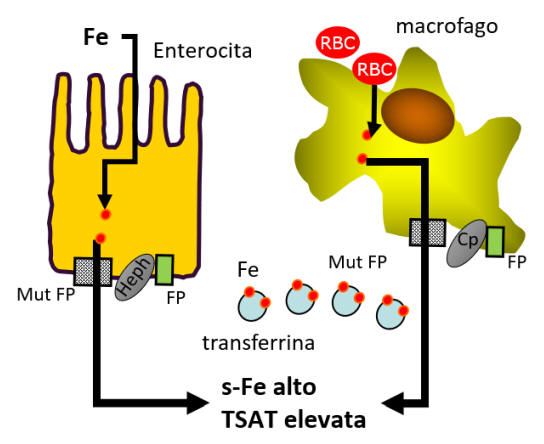
Figura
1. Le mutazioni 'gain-of-function' di ferroportina inducono un aumento
della funzione della proteina e un aumentato rilascio di ferro nel
sangue.
FP: ferroportina - Heph: efestina - Cp: ceruloplasmina - s-Fe:
ferro plasmatico - TSAT: saturazione transferrina
Deficit di ferroportina
Più frequentemente, le mutazioni del gene SLC40A1 causano una perdita di funzione (loss-of-function) della ferroportina. In questo caso la proteina mutata non raggiunge la membrana cellulare. Il risultato è una ridotta capacità di esporto del ferro che rimane in parte intrappolato nelle cellule. Questo determina lo sviluppo di un accumulo di ferro prevalentemente a carico delle cellule macrofagiche, ma non sufficiente a determinare una carenza di ferro circolante in condizioni standard.
Nella figura 2 è schematizzato il meccanismo che caratterizza questa patologia e conduce allo sviluppo del sovraccarico di ferro.
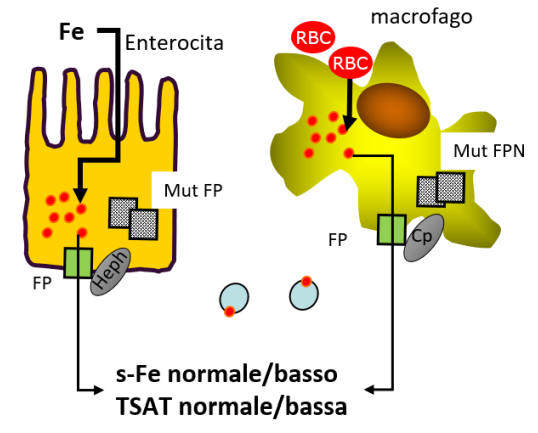
Figura 2. Le mutazioni 'loss-of-function' di ferroportina inducono
una ridotta funzione della proteina e un ridotto rilascio di ferro nel
sangue.
Dal punto di vista clinico le differenze sostanziali che distinguono il deficit di ferroportina dall'emocromatosi sono le seguenti:
- la concentrazione del ferro circolante è normale
- la saturazione della transferrina è normale e non aumentata come è caratteristico dell'emocromatosi
- il sovraccarico di ferro coinvolge prevalentemente le cellule del sistema reticolo-endoteliale (i macrofagi) ed eventualmente e solo tardivamente le cellule parenchimali (gli epatociti)
A causa dell'accumulo di ferro prevalente nei macrofagi, le
concentrazioni di ferritina sono spesso elevate o molto elevate in
misura sproporzionata rispetto alla reale concentrazione di ferro
epatico, almeno se confrontato con quanto si osserva nelle forme di
emocromatosi.
Dal punto di vista clinico, anche se la malattia è
caratterizzata da una discreta variabilità da persona a persona anche
all'interno della medesima famiglia, le manifestazioni sono generalmente
modeste ed è poco frequente osservare delle complicanze d'organo come si
osserva nell'emocromatosi.
Per potersi orientare in modo più preciso
di quanto possa fare il dosaggio della ferritina, può essere utile
eseguire una risonanza magnetica dedicata per quantificare il ferro nel
fegato e nella milza (vedere articolo
Biopsie magnetiche).
Anche la terapia, che si basa comunque sulla salassoterapia, deve
essere gestita in modo diverso da quanto si fa nell'emocromatosi.
Infatti, i salassi devono essere eseguiti con una frequenza che deve
tener conto della ridotta capacità di rilasciare il ferro da parte dei
macrofagi e dare il tempo al sistema di rilasciare il ferro necessario
per ricostituire la massa dei globuli rossi rimossi con il salasso.
Infatti, qualora si proceda con il medesimo approccio che si utilizza
nelle forme classiche di emocromatosi, è facile che il paziente possa
sviluppare un deficit di ferro funzionale (bassi livelli di ferro e
della saturazione della transferrina, malgrado valori di ferritina
ancora elevati) e un'anemizzazione.
Pertanto, generalmente, si
imposta un regime blando di un salasso al mese per verificare la
risposta del paziente sia per quanto riguarda i valori di emoglobina che
della saturazione della transferrina.
Poiché nel deficit di ferroportina, l'accumulo è prevalente nei
macrofagi e l'entità del sovraccarico nella parte più nobile degli
organi (i parenchimi) è modesto, questo approccio più blando non
costituisce un rischio per il paziente.
Tuttavia, nel caso la
risonanza magnetica dovesse evidenziare un accumulo di ferro più
significativo anche nel fegato, la salassoterapia può essere modulata in
modo diverso sempre però valutando la risposta del paziente sia dal
punto degli esami che da quello soggettivo.
prof. Alberto Piperno
[Articolo pubblicato il 14-09-2003 e aggiornato il 05-11-2023]
