EPCIDINA ED EMOCROMATOSI
L'emocromatosi è una malattia ereditaria che conduce al progressivo sviluppo
di un sovraccarico di ferro a livello di diversi organi e tessuti. A causa
dell'effetto tossico del ferro la struttura e la funzione degli organi
interessati può essere danneggiata e questo accade nello stadio conclamato di
malattia.
La maggior parte dei casi di emocromatosi genetica è ascrivibile ad un unico
gene chiamato HFE e alle sue due mutazioni più comuni (C282Y e H63D). Pertanto
questa forma è detta emocromatosi classica o emocromatosi HFE o
emocromatosi
tipo 1. Tuttavia negli ultimi anni sono stati descritti altri tipi di
emocromatosi genetica più rari e dovuti a difetti di altri geni coinvolti nella
regolazione del metabolismo del ferro:
- l'emocromatosi giovanile o tipo 2 che è una forma severa ad insorgenza precoce
dovuta ad alterazioni dei geni dell'emogiuvelina (2a) o dell'epcidina (2b);
- l'emocromatosi tipo 3 che si manifesta in età adulta e dipende da mutazioni nel
gene del recettore della transferrina 2;
- l'emocromatosi tipo 4 che a differenza delle precedenti si presenta spesso con
saturazione della transferrina normale, ed è dovuta a difetti della ferroportina.
In particolare approfondiremo in questo articolo il ruolo dell'epcidina, che è stata scoperta nel 2001. Il gene che codifica per questa proteina si chiama HAMP e si trova sul cromosoma 19. Sono state identificate solo due mutazioni del gene HAMP che, analogamente alle mutazioni del gene HFE, possono portare allo sviluppo dell'emocromatosi tipo 2b se presenti su entrambi i cromosomi ereditati dai genitori (malattia genetica recessiva). L'epcidina è una proteina di piccole dimensioni che funziona come ormone, portando un messaggio in tessuti e organi diversi da quello dove viene prodotto. E' un regolatore chiave dell'equilibrio del ferro nell'organismo (ferro-omeostasi): è prodotta dal fegato e blocca l'assorbimento intestinale del ferro e il rilascio di ferro dai macrofagi (le cellule che servono per riciclare il ferro contenuto nei globuli rossi dopo che questi muoiono), le due principali vie attraverso cui il ferro entra nel circolo.
Nell'individuo normale l'epcidina viene prodotta in quantità definite in funzione dello stato del ferro nel sangue, dei depositi nell'organismo e dell'attività eritropoietica (la produzione dei globuli rossi nel midollo che richiede ferro): se il ferro circolante o depositato si riduce o se l'attività eritropoietica aumenta viene inibita la produzione di epcidina e quindi "si apre la strada" all'ingresso del ferro nel sangue; al contrario, se il deposito di ferro dell'organismo tende ad aumentare e non è richiesto ferro da parte del midollo la produzione di epcidina blocca l'ingresso di ferro nel sangue.
L'epcidina svolge la sua azione modulatoria legandosi ad un'altra proteina chiamata ferroportina che regola l'uscita di ferro dalla cellula della mucosa intestinale e dalle cellule "di deposito" (in particolare il macrofago) al sangue. Quando l'epcidina è presente, si lega alla ferroportina, ne limita la funzione e blocca quindi l'uscita di ferro nel sangue. Quando l'epcidina è assente accade l'inverso.
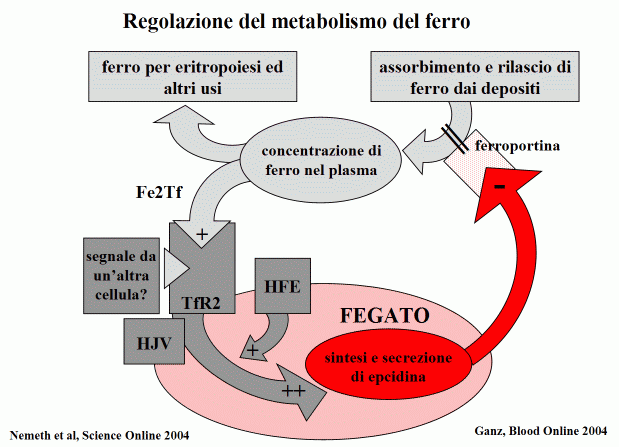
Vi sono due condizioni patologiche in cui la produzione di epcidina è speculare: l'emocromatosi e l'anemia delle malattie croniche. Nell'emocromatosi genetica (tutti i tipi tranne quello dovuto ai difetti della ferroportina), la produzione di epcidina è bassa (rispetto alla quantità di ferro depositato) e, poiché l'assorbimento di ferro intestinale e il rilascio di ferro dal macrofago aumentano, si sviluppa un progressivo accumulo di ferro. Al contrario, nell'anemia delle malattie croniche, seppure non siano aumentati né i depositi né il ferro circolante, la produzione di epcidina è alta e di conseguenza il ferro rimane bloccato nei macrofagi, l'assorbimento intestinale è inibito, il ferro non è disponibile per il midollo e si sviluppa un anemia caratterizzata da saturazione della transferrina bassa (indicativo del poco ferro circolante) e ferritina alta (espressione del ferro bloccato nei depositi).
Per quanto riguarda l'emocromatosi è necessario sottolineare che non tutti i soggetti che presentano un assetto genetico a rischio sviluppano la malattia. Ad esempio, solo il 25-50% degli omozigoti C282Y (ovvero coloro che hanno ereditato la mutazione da entrambi i genitori) hanno valori di ferritina e di saturazione della transferrina così alti da fare diagnosi di malattia, gli altri presentano tutt'al più valori solo lievemente elevati. Pertanto si può dire che anche l'emocromatosi come altre malattie necessita per esprimersi sia di una predisposizione genetica (ad esempio i genotipi HFE a rischio) ma anche di fattori aggiuntivi.
Da tempo sono noti i fattori acquisiti, malattie associate che possono determinare un aumento o una riduzione del sovraccarico di ferro attraverso numerosi meccanismi. Oggi la ricerca si sta concentrando sull'analisi di fattori genetici in grado di modulare l'espressione della malattia: l'epcidina potrebbe essere uno di questi. Si ipotizza che i pazienti con emocromatosi Classica ed espressione di malattia più severa (cioè indici del ferro più alti e maggiore sovraccarico di ferro) producano meno epcidina degli altri. Purtroppo non è possibile dosare nel sangue l'epcidina; valutarne l'escrezione nelle urine è molto complesso e oggi si fa solo in un centro di ricerca situato presso l'Università della California (UCLA), Los Angeles, diretto dal Prof. Ganz.
Ci è stato proposto di partecipare ad uno studio multicentrico che coinvolge diversi centri per lo studio dell'emocromatosi del nord Italia – quello che afferisce al Dipartimento di Medicina Clinica e Sperimentale dell'Ospedale San Raffaele di Milano coordinato dalla Prof.ssa Camaschella, quello del Dipartimento di Medicina Interna dell'Università di Verona condotto dal Dott. Girelli e il nostro. Il titolo del progetto è: "EFFETTO DI UNA DOSE ORALE DI FERRO SULLA ESCREZIONE URINARIA DI EPCIDINA, L'ORMONE REGOLATORIO DEL FERRO, IN PAZIENTI AFFETTI DA EMOCROMATOSI: UN TEST DI STIMOLO SUSCETTIBILE DI APPLICAZIONE CLINICA". Infatti è stato osservato che nel soggetto normale la somministrazione di una compressa di ferro solfato per bocca causa un aumento dell'escrezione urinaria di epcidina valutabile nelle successive 24 ore. Si vuole verificare se nel paziente affetto da emocromatosi ci sia una riduzione dell'escrezione di epcidina basale e dopo stimolo; si vuole inoltre verificare se effettivamente coloro che hanno una malattia più severa hanno valori di epcidina più bassi degli altri. Verranno valutate le eventuali modificazioni nella produzione di epcidina dopo la rimozione del ferro attraverso salassoterapia. Si deve precisare che dal momento che la dose di ferro somministrata è minima e singola non determina alcun problema per i pazienti, anche se già sovraccaricati di ferro. Il test potrebbe essere paragonato alla somministrazione di glucosio a pazienti con tolleranza glucidica ridotta per l'effettuazione di una curva da carico con glucosio.
Il protocollo di ricerca coinvolge pazienti affetti da emocromatosi HFE con genotipo C282Y omozigote o eterozigote composto C282Y/H63D. Viene eseguito in due momenti: alla diagnosi del sovraccarico di ferro ed una volta raggiunto lo stato di ferrodeplezione attraverso salassoterapia. Durante una prima visita uno dei medici dell'equipe di ricerca propone la partecipazione allo studio e consegna il materiale, che consiste in due barattoli per la raccolta delle urine e una compressa di ferro. Il test viene poi eseguito dal paziente al proprio domicilio: il giorno 1 al risveglio e a digiuno raccoglie un campione delle prime urine del mattino (50 ml) e quindi assume la compressa di ferro solfato 325 mg (contenente 65 mg di ferro); il giorno 2 raccoglie il secondo campione delle urine del mattino (50 ml) e si presenta al controllo clinico. In tale occasione il paziente consegna i campioni di urina e gli viene eseguito il prelievo di sangue per la definizione dei parametri del ferro (saturazione della transferrina, ferritina). I campioni di urine codificati e resi anonimi verranno conservati a -20°C e spediti al laboratorio dell'Università della California per il dosaggio dell'epcidina urinaria.
Se nel paziente con emocromatosi l'escrezione di epcidina fosse ridotta anche dopo il test ed in modo proporzionale all'espressione di malattia si prospettano alcune applicazioni cliniche: si potrebbe proporre il test di stimolo dell'epcidina come esame che predice il rischio di sviluppare l'emocromatosi in tutti i soggetti con predisposizione genetica per la malattia prima dello sviluppo della stessa. Inoltre in termini di ricerca si potrebbe pensare di estendere il test dell'epcidina a tutte le forme di emocromatosi non HFE correlate e di sovraccarico di ferro attualmente non spiegate.
Il ruolo dell'Associazione in questo progetto è soprattutto di sostenere economicamente lo studio, partecipando al rimborso del costo degli esami ematici che non sarebbero previsti per il follow-up clinico del paziente ed alle spese di spedizione del materiale biologico in USA.
Dott.ssa Paola Trombini
[Articolo pubblicato il 05-07-05]
