UNA PATOLOGIA CON ACCUMULO DI FERRO CEREBRALE: L'ACERULOPLASMINEMIA
Il ferro è un metallo bioattivo essenziale; partecipa a moltissime funzioni
in tutto l'organismo. A livello cerebrale, il ferro svolge funzioni essenziali
nei processi di:
- biosintesi di neurotrasmettitori (sostanze che veicolano
le informazioni fra le cellule componenti il sistema nervoso);
- formazione
della mielina (la sostanza che riveste, isola e protegge le fibre nervose);
-
metabolismo energetico.
Tuttavia, l'eccesso di ferro nel cervello può causare danni neuronali e morte cellulare, perché il ferro (Fe2+) aumenta lo stress ossidativo mediante la generazione di radicali liberi altamente citotossici.
Esiste un gruppo di patologie neurodegenerative (sindromi NBIA, acronimo di Neurodegeneration of the Brain with Iron Accumulation: neurodegerazione cerebrale con accumulo di ferro) caratterizzate da un accumulo di ferro prevalente in alcune sedi particolari del cervello: i nuclei o gangli della base localizzati alla base di entrambi gli emisferi cerebrali e densamente interconnessi con la corteccia cerebrale e altre strutture come il talamo e il tronco dell'encefalo (Figura 1).
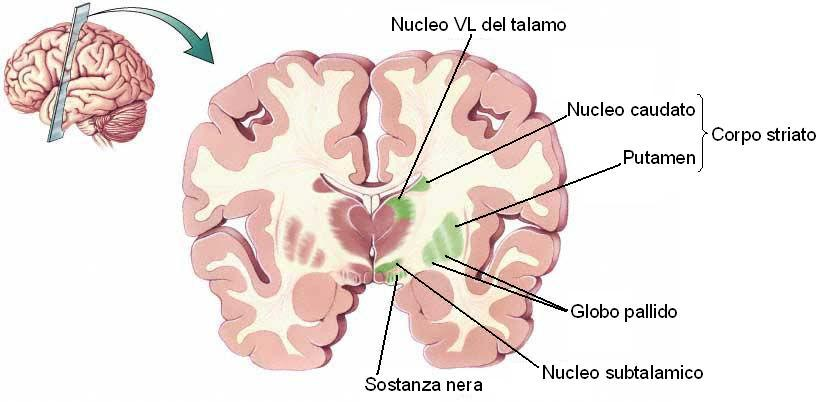
Figura 1: Sezione e anatomia del cervello.
Essi sono coinvolti principalmente nel controllo del movimento, ma anche negli aspetti motivazionali, emozionali e di attenzione che guidano i movimenti finalizzati. A supporto di questo ruolo, studi autoptici (post mortem) nell'uomo hanno riscontrato alterazioni patologiche nei nuclei della base in diverse malattie neurologiche degenerative tra cui il morbo di Parkinson e la corea di Huntington.
Le sindromi NBIA si manifestano clinicamente con un progressivo disturbo del movimento con comparsa di movimenti involontari (corea) e progressiva incapacità di mantenere il coordinamento motorio e una corretta deambulazione come sintomi principali. A livello tissutale si osserva una progressiva degenerazione sia dei neuroni (le cellule cerebrali per eccellenza) che degli astrociti (le cellule nervose che servono da impalcatura e da supporto alle funzioni dei neuroni).
Tra le sindromi NBIA, quelle direttamente imputate a difetti nei geni ferro-correlati ci sono la neuroferritinopatia e l'aceruloplasminemia (ACP) causate da mutazioni a carico del gene della ferritina L (FTL) e ceruloplasmina (CP), rispettivamente.
Il primo caso di ACP (OMIM, #604290) è stato documentato in Giappone nel 1987 da Miyajima H che ha descritto una donna di 52 anni che soffriva di disturbi dell'attività muscolare palpebrale (blefarospasmo), degenerazione retinica, diabete mellito, anemia microcitica (globuli rossi piccoli) con bassi livelli di ferro nel sangue, ma con elevati livelli di ferritina. La donna presentava un accumulo di ferro nel cervello (valutato mediante risonanza magnetica), nel fegato e nel pancreas e l'assenza della ceruloplasmina plasmatica (Cp). Successive analisi hanno rivelato la presenza di una mutazione in omozigosi nel gene CP, localizzato sul cromosoma 3q23.
La ceruloplasmina è una rame-ossidasi e contiene il 95% di rame presente nel siero umano. Viene inizialmente sintetizzata come apo-proteina (priva di rame) che, quando lega sei atomi di rame, si modifica nella forma olo (chiamata ceruloplasmina) (Figura 2).
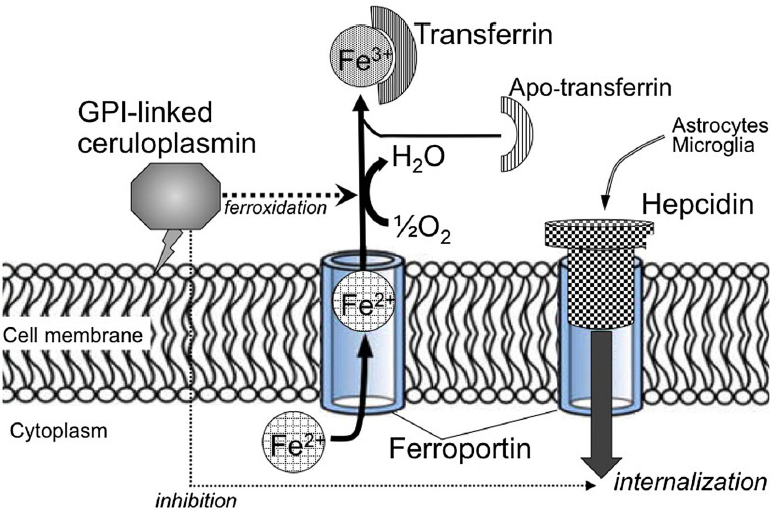
Figura 2: Biosintesi della ceruloplasmina (tratto da Kono S, 2013).
Esistono due forme distinte di Cp (isoforme) generate dal medesimo gene: una forma che viene secreta nel sangue (ceruloplasmina sierica) lunga 1040 aminoacidi ed una forma di membrana (GPI-linked) contenente 25 aminoacidi in più. L'isoforma secreta è espressa solo negli epatociti, mentre la forma GPI è espressa nel cervello, fegato, polmoni, reni e molti altri organi.
La malattia ACP rivela il ruolo della Cp nell'omeostasi del ferro. Essa gioca un'importante funzione nel processo che regola l'efflusso del ferro dalle cellule attraverso la ferroportina (la proteina che svolge il ruolo di esporto del ferro). Infatti, la Cp, ossidando il ferro ferroso Fe2+ a ferro ferrico Fe3+ favorisce il legame del ferro alla transferrina extracellulare (Figura 3).
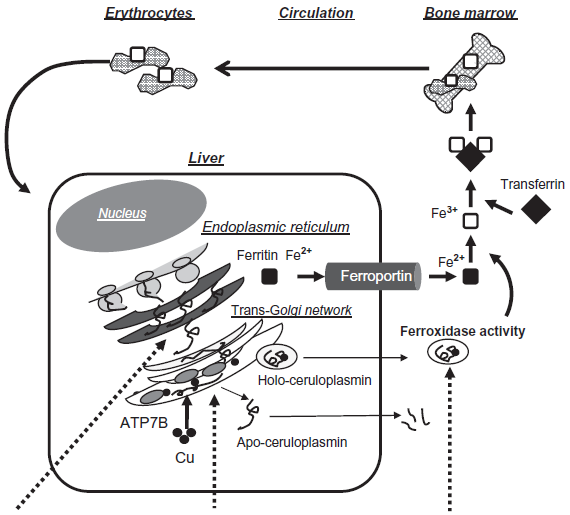
Figura 3: Trasporto del ferro a livello della membrana degli astrociti (tratto da Miyajima H, 2015).
La ferroportina è regolata a livello post-traduzionale attraverso la sua internalizzazione e successiva degradazione ad opera di epcidina. Studi di De Domenico et al nel 2007 hanno dimostrato che l'attività ferrossidasica della GPI-CP è essenziale per la stabilità in membrana della ferroportina nelle linee murine di glioma. Il ridotto rilascio di ferro alla transferrina, conseguenza della disfunzione della ceruloplasmina, determina le manifestazioni classiche della patologia:
1. anemia microcitica
ferro-carenziale;
2. accumulo di ferro tissutale sia a livello sistemico
che cerebrale.
A sua volta l'anemia ferro-carenziale determina quelle modificazioni a livello della sintesi di epcidina (l'ormone regolatore del metabolismo del ferro) che aumenta l'assorbimento del ferro a livello intestinale, distretto in cui l'efestina (l'omologo di ceruloplasmina) mantiene la sua attività ferrossidasica coinvolta nel trasporto di ferro dagli alimenti al sangue. Ciò contribuisce ad aumentare l'accumulo di ferro cellulare, esacerbando la patologia.
Lo stesso meccanismo avviene a livello cerebrale in cui la GPI-CP legata alla membrana degli astrociti serve a trasformare il Fe2+ in Fe3+ così da essere trasportato dalla transferrina per il suo trasporto ai neuroni. Nel cervello inoltre un altro importante ruolo della ceruloplasmina è quello di antiossidante, che preserva il sistema nervoso centrale dai danni mediati dai radicali liberi (°OH) formatisi in seguito alla Reazione di Fenton tra lo ione Fe2+ e l'H2O2.
A supporto di ciò esistono dati che evidenziano l'aumento della perossidazione lipidica e del danno mitocondriale nei tessuti cerebrali, nel liquido spinale e negli eritrociti di pazienti affetti da ACP. Tutto ciò porta alla degenerazione neuronale correlata con la distribuzione dell'accumulo di ferro a livello dei nuclei della base.
Da
un punto di vista clinico, l'ACP è l'unica tra le sindromi da
sovraccarico di ferro che coinvolge sia il ferro sistemico che il
metabolismo cerebrale. Le manifestazioni cliniche sono caratterizzate
dalla cosiddetta triade: degenerazione retinica, DM e segni/sintomi
neurologici.
Le manifestazioni neurologiche (in ordine di frequenza)
comprendono incoordinamento motorio, movimenti involontari, disfunzioni
cognitive e parkinsonismo, sintomi corrispondenti alle specifiche
regioni cerebrali interessate dall'accumulo di ferro.
Questi compaiono generalmente nella quarta o quinta decade di vita. Tuttavia, l'espressione fenotipica della malattia varia anche all'interno delle famiglie.
La diagnosi di ACP in un individuo asintomatico si basa sulla dimostrazione della completa assenza di ceruloplasmina sierica e la presenza di anemia microcitica, bassi livelli di ferro plasmatico (iposideremia) ed un aumento della concentrazione di ferritina sierica oltre a studi di imaging che mettono in evidenza il sovraccarico di ferro a livello epatico e cerebrale. Il test genetico di sequenziamento dell'intero gene CP, conferma la diagnosi.
I sintomi, l'età d'insorgenza e la prognosi dei singoli casi è variabile e non sempre correlabile con il tipo di difetto genetico. La frequenza stimata in Giappone è di 1 individuo ogni 2.000.000 e ad oggi sono note circa 70 varianti patogeniche in più di 60 famiglie nel mondo, una decina delle quali in Italia (Figura 4).
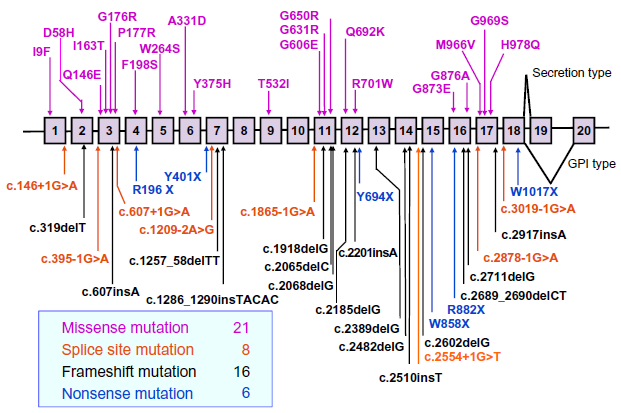
Figura 4: Distribuzione delle mutazioni nei 20 esoni del gene CP (tratto da Kono S, 2013).
Essendo un disordine neurodegenerativo lentamente progressivo, la sua diagnosi precoce ed il tempestivo inizio del trattamento diventano questioni di cruciale importanza. Per ridurre il danno da ferro, la terapia chelante sistemica è in uso nella cura dei pazienti e si basa sui farmaci oggi disponibili (deferoxamina per via sottocutanea, deferiprone o deferasirox per via orale) a dosaggi inferiori a quelli comunemente utilizzati nelle patologie da sovraccarico di ferro genetico più comuni (emocromatosi o talassemie).
Tale terapia è risultata abbastanza efficace nel rimuovere il ferro in eccesso a livello sistemico, ma poco o per nulla efficace nel rimuovere il ferro a livello cerebrale e migliorare i sintomi neurodegenerativi della malattia. Studi preliminari sembrano suggerire una potenziale efficacia della somministrazione della proteina sotto forma di infusioni di plasma.
Servono quindi ulteriori studi per caratterizzare sia le mutazioni del gene e meglio definire l'eterogeneità della malattia e studi in vivo per identificare terapie adeguate, utili soprattutto alla cura degli aspetti neurologici in modo da poterne prevenire e/o arrestare i danni.
Dr.ssa Sara Pelucchi
[Articolo pubblicato il 05-05-2018]
